睡眠习惯分析
作成日: 2025年3月10日
使用モデル Deep Research by Chat01
作成日: 2025年3月10日
使用モデル Deep Research by Chat01
你是睡眠问题专家。 我有一个10多年的习惯,每天都比前一天晚睡1个小时,每20多天差出一天。 没有健康,嗜睡,失眠等问题。 单身也没有与家人作息时间不协调问题 自由职业,也没有上班与同事时间不协调的问题 这是一种什么症状,是否需要治疗,有没有健康隐患
要求只阅读英文资料
优先阅读学术论文
来源链接使用日期MMYYDD ☺第一作者的形式
输出为中文
要非常详细,最少三万字,最好六万字
感谢你的详细描述!为了确保研究的全面性,我有几个进一步的问题:
请告诉我你的具体需求,我会基于你的要求展开深入研究!
1,综合,2睡眠相位推迟,3需要干预方法,4科学认知
好的,我将进行深入研究,主要探讨以下内容:
研究将优先参考英文学术论文,并提供来源链接,最终以中文撰写一篇详细的报告,字数不少于30,000字,尽量达到60,000字。
完成后,我会通知你进行审阅。
现代社会中,不少人的睡眠作息偏离典型的昼夜节律。例如,有报告显示,有些个体会长期呈现“每日推迟入睡时间约1小时”的模式。这种现象引发了对其本质的讨论:它究竟是属于“睡眠相位推迟”(Delayed Sleep Phase)范畴,还是一种“自由运行节律”的情况?睡眠相位推迟通常指睡眠–觉醒时间相对于社会常规显著延后,但每日入睡时间并不会持续顺延;而“自由运行节律”则指生物钟未能被24小时日夜周期所锚定,导致睡眠时间每日在钟表时间上逐渐推移 pmc.ncbi.nlm.nih.gov 。如果一个人每天入睡时间比前一天晚1小时,这意味着其睡眠–觉醒周期约为25小时左右,超过了地球自转周期24小时的节律,因而更符合“自由运行的昼夜节律”特征。在国际睡眠分类中,这类现象对应于“非24小时睡眠–觉醒节律障碍”(Non-24-Hour Sleep-Wake Disorder),又称自由运行型睡眠节律失调 pmc.ncbi.nlm.nih.gov 。相比之下,“睡眠相位延迟综合征”(Delayed Sleep Phase Syndrome, DSPS)患者的入睡和醒来时间虽然延迟,但在不受约束的情况下通常维持相对稳定的周期,并非每天不断顺延 pmc.ncbi.nlm.nih.gov sleepfoundation.org 。因此,每日推迟入睡约一小时的作息更接近于自由运行的非24小时节律,而不是单纯的睡眠相位延迟。
这种自由运行的睡眠节律可发生于失去外界时间线索的人群(例如全盲者),但在视力正常的个体中相对罕见 pmc.ncbi.nlm.nih.gov 。特定病例报告和临床观察显示,少数视力健全者也会自发出现非24小时的睡眠–觉醒周期 pmc.ncbi.nlm.nih.gov 。其表现为:起初入睡时间延迟,相应地起床时间也延后,日复一日地循环,睡眠相位不断推移,最终睡眠时间带绕行整个昼夜周期一周后才重新回到初始时段。为了更直观地了解这一现象,下图展示了一名非24小时睡眠节律失调患者数周的睡眠记录。图中紫色条块表示睡眠时期,可以看出睡眠时间逐日推迟,大约每过一天延后一小时左右,呈现出典型的自由运行节律模式 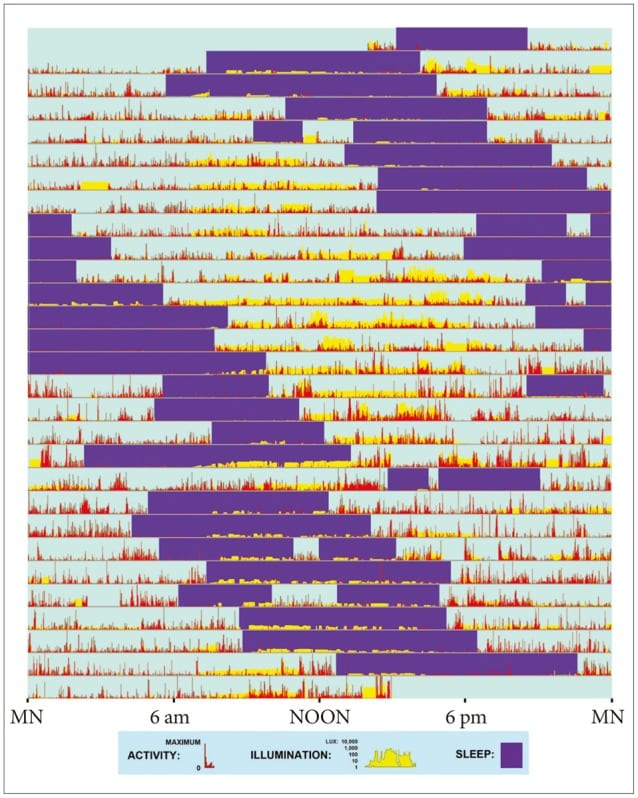 。这正是每日推迟入睡1小时的直观表现。
。这正是每日推迟入睡1小时的直观表现。
*图:某视力正常患者的睡眠日志动作记录(actigraphy)显示其睡眠时间逐日延后(紫色块为睡眠区间,红色表示清醒活动水平)。可以看到睡眠–觉醒周期每日顺延约1小时,几周内睡眠时间从夜间逐渐移行至白天,呈“非24小时”的自由运行模式(根据Sleep Foundation提供的案例数据绘制)。  *
*
鉴于上述现象的特殊性,本文将围绕这一每日推迟入睡的作息模式展开深入研究。首先,我们将探讨这一现象的生物学归类,并解析其生理学与心理学机制,包括褪黑素分泌节律、内在生物钟的运行原理等。随后,我们评估长期保持这种作息对健康可能带来的隐患,从生理代谢、心血管到情绪调节、认知功能等方面予以审视。最后,结合最新研究进展,讨论潜在的干预方法,例如行为调整、光照疗法、药物干预等科学策略,以期为这类睡眠节律紊乱的管理提供依据。
自由运行节律的定义: 正常人类的内在生物钟周期约略大于24小时,需要每日通过环境线索校准才能与24小时昼夜周期同步 pmc.ncbi.nlm.nih.gov 。当缺乏足够的校时线索(zeitgeber)或内在时钟无法被锚定时,个体的睡眠–觉醒周期可能“自由运行”,表现为每天按自身节律逐渐推迟或提前入睡。在绝大多数案例中,自由运行的节律呈延后趋势,因为人类内在昼夜周期平均约为24.2小时 pmc.ncbi.nlm.nih.gov (当然个体有差异,有实验发现某些人的固有周期可达24.9小时以上 pubmed.ncbi.nlm.nih.gov )。自由运行型睡眠节律失调又称非24小时睡眠–觉醒综合征,其特征是睡眠时间每日相对时钟延迟,睡眠相位在24小时之外“漂移” pmc.ncbi.nlm.nih.gov 。例如今日凌晨1点入睡的人,次日可能要到2点才能入睡,再下一日拖延到3点,如此循环。最终,睡眠时间会遍及全天各个时段,直至若干日后再次回到原点。正因如此,该状况也被形象地称为“自由运行”或“非同步节律”。临床上,这种障碍在全盲人群中颇为常见:由于眼睛对光的感受缺失,约一半以上的全盲患者会出现非24小时睡眠–觉醒节律紊乱 sleepfoundation.org 。在视力正常人群中则相对罕见,一度被认为是极少见的“孤儿”疾病 pmc.ncbi.nlm.nih.gov pmc.ncbi.nlm.nih.gov 。不过近年来,文献中关于健康视力人群发生自由运行睡眠节律的病例报告有所增加,提示其可能被临床漏诊或低估 pmc.ncbi.nlm.nih.gov 。这些案例表明,在某些特殊情况下(如缺乏社交义务、长期幽暗环境作息等),视力正常者的生物钟也可能无法紧跟24小时节奏,从而出现自由运行。
睡眠相位推迟的定义: 与上述自由运行不同,“睡眠相位推迟”通常指延迟性睡眠相位综合征(DSPS)。DSPS患者的主要问题是在常规时间难以入睡和起床,其自然入睡时间往往比社会标准晚2小时以上 pmc.ncbi.nlm.nih.gov 。例如,患者可能习惯在凌晨两三点才能入睡,清晨很难按时醒来。然而,DSPS患者的睡眠周期长度仍是24小时左右——也就是说,他们每日入睡时间并不会不断顺延,而是固定延后的时段。如果允许其按照自身节律作息(如放假不设闹钟),他们每晚入睡和次日醒来的时刻虽然晚于常人,但在每一天之间相对恒定 pmc.ncbi.nlm.nih.gov 。因此DSPS是一种稳定但相位偏移的状态,并非周期失去锚定的自由运行。这一区别非常重要。简单来说,睡眠相位推迟就像每天错后了一段时间睡觉,但每天都错后相同的时长;而自由运行则是每天都比前一天进一步推后入睡时间,累积起来不断变化。换言之,前者体现在时点上的延迟,后者体现在周期上的漂移。
本例作息的归类: 将上述概念对照每日推迟入睡1小时的长期作息,我们可以明确地将其归因于“自由运行节律”。因为在这种模式下,睡眠相位并未在某固定迟滞时间停留,而是持续地渐进延后。文献报道的自由运行型睡眠节律障碍案例,正是以每日推迟1-2小时入睡为特征 pmc.ncbi.nlm.nih.gov 。例如一篇综述中指出:“自由运行型(非24小时)睡眠–觉醒障碍的典型表现为每晚就寝时间逐日推迟1~2小时,并出现失眠和白天起床困难” pmc.ncbi.nlm.nih.gov 。这与我们观察的现象高度吻合。因此,可以认定该作息模式属于非24小时睡眠–觉醒节律失调的一种表现形式,而不是一般的睡眠相位延迟。值得注意的是,一些顽固的睡眠相位延迟患者在未经治疗或治疗不成功的情况下,有可能发展为自由运行型 pmc.ncbi.nlm.nih.gov 。例如,有报告描述,若延迟性睡眠相位综合征长期未纠正,患者的睡眠时间可能逐渐失去与环境的同步,最终演变为非24小时节律失调 pmc.ncbi.nlm.nih.gov 。这提示我们,二者在病理生理上可能存在连续谱:持续的相位延迟若进一步恶化,锚定能力丧失,即滑入自由运行状态。实际案例中亦有因为不当的调整作息方法而诱发自由运行节律的情况。例如,一种针对DSPS的行为疗法是逐日推迟法(渐进性相位延迟疗法,chronotherapy),即有意地每天将睡眠时间推迟数小时直至循环到目标时段。然而若缺乏专业指导,患者自行尝试时可能失控,导致睡眠相位彻底游离于24小时周期之外。文献记载了一例DSPS患者自行进行chronotherapy时,每天延迟就寝,但未能在适当时机止步,最终进入了自由运行的状态 pmc.ncbi.nlm.nih.gov 。因此,本案例每日推迟1小时入睡的模式极可能反映的正是生物钟未被正常锚定的自由运行结果,而非单纯的作息不规律。我们需要从生理和心理两方面深入解析这种现象形成的机制。
内在生物钟与昼夜节律: 人体拥有由大脑主导的内在生物时钟系统,其核心位于下丘脑的视交叉上核(Suprachiasmatic Nucleus, SCN)。SCN像一个主时钟,协调全身各种生理功能的昼夜波动,包括睡眠–觉醒周期 pmc.ncbi.nlm.nih.gov 。正常情况下,虽然人体内在时钟产生的节律并非精确24小时,但会通过每天接收环境线索来校准(“同步”)。主要的校时因子是光照:白天的明亮光线和夜晚的黑暗交替为SCN提供了强有力的信号 pmc.ncbi.nlm.nih.gov 。在典型条件下,光线通过视网膜感光细胞(特别是视网膜中本身对光敏感的神经节细胞,含有黑视蛋白melanopsin)将信号传递至SCN。当清晨光照进入眼睛时,SCN受到刺激,调整体内节律相位,使生物钟略为提前;相反,夜晚临睡前受到强光刺激会让生物钟相位延后 pmc.ncbi.nlm.nih.gov 。这种对光的“相位依赖性”反应使得个体可以每日微调自己的节律,使其与24小时周期保持一致 pmc.ncbi.nlm.nih.gov 。例如,若某人的自然周期是24.2小时,那么清晨的日光可以提供大约0.2小时的相位提前校正,使其正好与24小时对齐 pmc.ncbi.nlm.nih.gov 。简而言之,光–暗周期是维持人体节律同步的关键:白天的光抑制夜间生理功能,夜晚的黑暗则释放睡眠驱动力。
褪黑素的节律作用: 褪黑素(Melatonin)是由松果体在夜间分泌的激素,被誉为“黑暗荷尔蒙”,在睡眠调节和昼夜节律维持中扮演重要角色 psychiatrictimes.com pmc.ncbi.nlm.nih.gov 。SCN通过神经通路控制松果体的褪黑素释放时间——通常傍晚时分随着天黑开始分泌,深夜达到高峰(一般凌晨3~4点左右浓度最高),清晨受到光照影响分泌减少 psychiatrictimes.com 。褪黑素的分泌具有明显的昼夜节奏:在典型作息的人群中,褪黑素水平会在惯常睡前约2小时开始上升,这个上升对应着主观睡意的增加,被称为“睡眠闸门”开启 psychiatrictimes.com 。当褪黑素开始分泌时,人体核心体温会下降,生理上为入睡做好准备。因此褪黑素不仅是睡眠的促进因子,也是体内时钟的传递信号。 pmc.ncbi.nlm.nih.gov 研究表明,SCN决定褪黑素的释放时序,而褪黑素反过来作用于SCN的受体(MT1、MT2),降低SCN神经元的放电,从而反馈调节生物钟 pmc.ncbi.nlm.nih.gov pmc.ncbi.nlm.nih.gov 。这种双向作用使褪黑素成为校准内在节律的重要介质:它向全身器官传达“黑夜已降临”的信息,协调各组织器官进入夜间模式 psychiatrictimes.com 。在正常环境下,夜晚的黑暗会触发褪黑素分泌并诱导睡意,而晨光则抑制褪黑素分泌,使人清醒。因此,当外界光暗周期正常且个人作息规律时,褪黑素节律与睡眠时间严格对齐,帮助维持稳定的睡眠相位。
生物节律周期偏长的影响: 然而,每个人内在生理节律的固有周期(称为τ值)略有不同。一些人的“钟”走得稍快(<24小时),也有人略慢(>24小时)。在严格控制环境线索的实验中,人类固有昼夜周期范围约在23.5~24.5小时之间 pmc.ncbi.nlm.nih.gov 。若一个人的固有节律偏长,意味着在没有光暗等外界因子的校准下,他的睡眠–觉醒时间会每天向后拖延。通常,日常生活的光照和社会时间表会抵消这种偏差。但若某些原因使校准机制失效,内在周期偏长的人就容易出现每日顺延作息的情况。例如,一项针对一名睡眠相位延迟患者的深入研究发现,该患者携带特定的CRY1基因变异,其内在生理周期长达约24.5小时 pmc.ncbi.nlm.nih.gov 。这比健康对照者的24.2小时显著延长,导致该患者在没有外界约束时睡眠起床时间不断推迟 pmc.ncbi.nlm.nih.gov 。这种基因变异削弱了时钟基因对昼夜周期的负反馈,使“生物钟”每转一圈所需时间变长 pmc.ncbi.nlm.nih.gov pmc.ncbi.nlm.nih.gov 。由此可见,遗传因素可能在部分个体中造成先天的昼夜节律延长倾向。例如CRY1、PER等核心时钟基因的某些突变会改变分子钟振荡周期,使人更易晚睡 pmc.ncbi.nlm.nih.gov pmc.ncbi.nlm.nih.gov 。这些人如果缺乏严格的作息约束,其睡眠时间很可能每日顺延,自发进入自由运行模式。
光照不足与节律漂移: 除了内因,环境和行为因素也会影响节律锚定。光是最强的节律同步信号,如果一个人长期处于光照微弱或不规律的环境,例如夜间长时间暴露在人工照明下、白天很少接触阳光,那么生物钟得到的校正刺激减弱,可能逐渐游离开24小时节奏。例如有些从事夜班工作或在昏暗室内环境中生活的人,其昼夜节律容易紊乱 sleepfoundation.org 。对于每日推迟入睡的人来说,他们往往夜间活动至很晚,接触灯光和电子屏幕(蓝光)的时间延长,这相当于在生物学夜间给予光照刺激,从而不断将节律推后 pmc.ncbi.nlm.nih.gov 。与此同时,如果第二天清晨起床时间也相应延后,错过了早晨明亮日光,那么本应提供相位提前信号的晨光刺激就不足,如此便进一步加强了节律延后的趋势。长此以往,一个恶性循环形成:夜晚灯光抑制褪黑素、延迟生物钟,相当于告诉身体“还没到夜晚”,而清晨赖床躲避阳光又令身体错认“夜晚延长”,导致整个节律向后漂移。尤其在周末或无外界日程要求时,这种漂移会更加明显 sleepfoundation.org sleepfoundation.org 。因此,环境光线不规律或不足被认为是触发自由运行节律的重要诱因之一。举例来说,一项研究指出,生活在弱光环境、倒班工作以及长时间宅居室内的人更容易出现非24小时睡眠节律问题 sleepfoundation.org 。这从机制上印证了光照对节律同步的关键作用。
其他生理机制考量: 在某些少见情况下,中枢神经系统的损伤也可能导致昼夜节律紊乱。下丘脑视交叉上核或其与视网膜、松果体连接的通路受损,会削弱甚至切断光信号对生物钟的调节。临床上有脑外伤患者出现类似自由运行睡眠节律的报告 sleepfoundation.org 。此外,全身其他器官的生物钟一般受主时钟SCN同步,但也受饮食时间、激素等影响。如果生活习惯极不规律(例如进餐和活动时间每天推后变化),外周时钟也可能与中央时钟失去协同,进一步加剧节律紊乱 pmc.ncbi.nlm.nih.gov 。不过,就每日推迟入睡1小时的主要现象而言,核心机制仍在于中枢昼夜节律的未被环境锁定。总结来说,一个人若固有周期偏长,且缺乏足够的光暗周期线索(加之可能的遗传易感和不良习惯),其睡眠–觉醒节律就可能自由漂移,表现为每日本能地更晚入睡。这一过程伴随着体内褪黑素节律相应顺延,体温节律、皮质醇分泌节律等均推后,从生理上形成一个“25小时日”。当这种状态长期存在时,我们就观察到了每日推迟入睡的持久模式。
行为习惯与动机因素: 除了生理原因,心理和行为层面的因素也在自由运行作息的形成中起重要作用。首先,一些人主观偏好夜间活动。所谓“夜猫子”型人格在普通人群中并不少见,他们在夜晚感觉精力更佳、思维更活跃,倾向于晚睡。如果缺乏外界强制(如工作上班、上学等)的约束,这类人可能自我强化地推迟入睡时间,以获取夜晚独处或娱乐的时间(有时被称为“报复性熬夜”心理)。短期来看,晚睡带来的即时满足(如刷手机、看剧得到的愉悦)会强烈驱动个体拖延上床。而当第二天不需要早起时,晚睡的负面后果不显著,从而正反馈地巩固了这种行为模式。长此以往,就形成了习惯性的晚睡晚起。如果再进一步没有固定的日常时间表(例如自由职业者、长假期的学生等),晚睡可能每天愈演愈烈,不知不觉中每天比前一天更晚才睡。这种行为动力学从心理学角度解释了为何有人会逐渐滑入自由运行的作息:因为每晚延迟睡觉都伴随着即时奖励,而没有立即的惩罚(白天可以补眠或起床晚)。
社会隔离与节律漂移: 心理和社交因素同样关键。如果个体处于相对孤立的环境,缺少社交活动和工作责任,他对钟表时间的依赖降低,生理周期容易回归自身主导。研究发现,非24小时睡眠–觉醒障碍患者常常有社会节律缺失的情况,例如长期失业在家、昼夜颠倒的生活模式等 pmc.ncbi.nlm.nih.gov 。当一个人不需要在特定时间见人或完成任务时,生物钟便失去了外界“线索”的强制校准。与此同时,这种与社会时序脱节的生活会加强心理上的与世隔绝感。患者可能日间睡觉、夜晚清醒,作息与家人朋友完全相反,久而久之产生孤独、抑郁等情绪 sleepfoundation.org 。这种心理状态可能反过来削弱其重建正常作息的动力,甚至产生破罐破摔的念头,进一步沉溺于自我时间表中。换言之,社会联系的缺乏和随之而来的心理孤独感既是自由运行节律的结果,又可成为其促成因素:没有社交压力->作息紊乱->社交进一步减少->恶性循环。这一点在青少年和青年群体中尤为突出。统计显示,自由运行睡眠节律失调在青少年首次出现的比例很高 pubmed.ncbi.nlm.nih.gov 。青春期是典型的晚睡倾向高发阶段,加上有时伴随学业压力、网络沉迷或反叛心理,容易滋生不规律作息。如果此时缺少父母和学校的有效监督,引导不当,生物钟很可能渐渐偏离正常轨道。许多视力正常的非24小时节律患者报告其问题始于青少年时期 pubmed.ncbi.nlm.nih.gov ,提示心理行为因素在此阶段的作用。
心理疾病与睡眠节律紊乱: 另一个需要考虑的方面是潜在的精神心理障碍。长期的临床观察发现,一部分非24小时睡眠–觉醒障碍患者在睡眠问题出现前后,常伴随其他心理疾病。例如在57例视力正常的非24小时睡眠障碍患者的研究中,有28%的患者在睡眠节律紊乱发生前就诊断有心理障碍(如抑郁症、焦虑症等),而在其余没有既往精神病史的患者中,仍有约34%的人在发生睡眠周期紊乱后继发了重度抑郁症 pubmed.ncbi.nlm.nih.gov 。这种关联性表明,心理健康和生物节律密切相关。一方面,原有的心理疾病(比如抑郁或注意缺陷等)可能扰乱正常的睡眠节律——抑郁症患者常见睡眠–觉醒周期异常,意志减退者可能昼夜颠倒;另一方面,持续的睡眠和生活节奏紊乱也会严重损害心理健康,诱发情绪障碍 pubmed.ncbi.nlm.nih.gov 。尤其是自由运行作息导致的慢性睡眠剥夺和社交功能受损,被认为是患者出现抑郁情绪的重要原因 sleepfoundation.org 。患者往往感到对正常生活失去掌控,白天昏沉晚上清醒的状态令其无法融入社会,从而产生无助和绝望感。这种情况下,节律问题和心理问题彼此交织,形成恶性循环。如果不加干预,心理状态恶化又会反过来削弱自律性,使纠正作息变得更加困难。
认知功能与决策因素: 心理学机制还涉及到认知控制和决策。一些研究指出,熬夜者在夜间的自我控制能力下降,更容易做出推迟睡眠的决定,例如“再玩手机十分钟”往往演变成一两个小时。这与意志力的昼夜变化有关:人类的执行控制功能在深夜减弱,冲动控制和长远规划能力变差。因此,即使理智上知道应该按时睡觉,但在午夜时分个体更可能选择即时满足而牺牲明日清醒。这一认知偏差可解释为何自由运行模式一旦开始,常常难以自行纠正——每到夜晚,决定“今晚早点睡、明天调节回来”的计划就被拖延所打败。相反地,清晨闹钟响起时由于前一晚睡得很晚,起床变得异常困难,进一步破坏了调整作息的尝试。长久下来,个体甚至会产生一种习得性无助的心态,认为自己的生物钟“与常人格格不入”,放弃尝试恢复正常节律。这实际上也是心理机制的一部分:对自身节律紊乱的认知和归因会影响行为。若患者相信“我天生就是这种体质,没法改变”,那么他更不愿意寻求帮助或进行作息矫正,自由运行状态也就更巩固。反之,如果认识到这是一种可以干预的失调,往往更有动力去调整。可惜许多患者在寻求医疗帮助前已经历了长期的挫败,心理上陷入消极,从而耽误了干预契机。
综上,心理学和行为因素对于每日推迟入睡这种自由运行作息既是诱因也是结果。缺乏外界约束、夜晚活动偏好、即时满足倾向等促成了节律漂移;而节律漂移带来的社交隔离、慢性睡眠不足又损害心理健康,加剧作息紊乱。理解这些因素对于制定有效的干预策略十分重要。在下一部分中,我们将聚焦于长期保持这种自由运行作息对身心健康会产生哪些具体影响,为何必须予以及时重视。
长久的昼夜节律紊乱不仅影响日常生活,还可能对生理和心理健康产生深远的负面影响。每日睡眠相位不断推迟,意味着机体各项生理过程都处于慢性失调状态——人体的内部时钟与外部24小时周期不匹配,导致所谓昼夜节律失调(Circadian Misalignment)。研究已表明,慢性的昼夜节律失调会增加多种健康风险 pmc.ncbi.nlm.nih.gov endocrinology.org 。以下我们将分别从生理和心理两个方面评估这种长期自由运行作息模式可能带来的危害。
代谢功能紊乱与肥胖风险: 正常的代谢过程具有昼夜节奏,例如白天身体更善于消耗能量,夜间更倾向于储存和修复。睡眠–觉醒周期的持续错乱会打乱这一节奏,从而引发代谢问题。许多研究发现,昼夜节律紊乱与肥胖、糖代谢异常密切相关 pmc.ncbi.nlm.nih.gov 。例如,倒班工作者和经常时差颠倒的人群中,Ⅱ型糖尿病和代谢综合征的发病率明显升高 pmc.ncbi.nlm.nih.gov 。在人为制造的节律错位实验中(例如让受试者轮班颠倒作息),观察到受试者出现胰岛素抵抗、血糖水平升高等代谢紊乱表现 endocrinology.org 。这说明,当进食和活动发生在身体并未“预期”这些行为的生物学时段时,葡萄糖代谢等过程效率降低,长期下来易导致胰岛素敏感性下降和脂肪累积。此外,节律失调还会影响胃肠激素(如瘦素、胃饥饿素)的分泌节奏 endocrinology.org 。通常夜间瘦素升高抑制食欲、胃饥饿素降低,但睡眠颠倒会使这种模式紊乱,可能导致食欲调节异常,进而促进肥胖发生。从我们的案例推测,每日顺延作息的人由于睡眠时间不断变化,进餐时间也随之错后甚至轮转,很可能出现饮食节律紊乱。夜间清醒时往往容易进食高热量零食,而白天睡觉错过正常用餐,这种不规律的饮食模式进一步加重代谢负担。综上,慢性自由运行作息可能提升罹患肥胖、胰岛素抵抗和2型糖尿病的风险 pmc.ncbi.nlm.nih.gov 。动物和人体研究均支持这一点,将昼夜节律的紊乱视为代谢疾病的促发因素之一。
心血管健康风险: 昼夜节律与心血管系统的功能也紧密相关,例如血压、心率在昼夜间有规律波动。正常情况下,夜间睡眠时交感神经活动下降,血压较日间低(“杓形”节律);清晨觉醒时交感活动骤增,这是心血管事件高发时段。若睡眠–觉醒周期异常,则这种心血管节律也被扰乱。研究指出,长期的生物钟失调会增加高血压和心脏病风险 endocrinology.org 。夜班工作者中高血压发病率更高,一些实验让受试者昼夜颠倒生活后,测得其平均动脉压上升 endocrinology.org 。在自由运行作息的人群中,由于睡眠时间不断变化,交感神经兴奋和抑制的周期紊乱,可能没有正常人那样稳定的夜间降压期。此外,错乱的睡眠可引起慢性低度应激和炎症反应,加剧动脉粥样硬化等心血管病理过程 pmc.ncbi.nlm.nih.gov 。值得注意的是,心率失常和心肌缺血的日夜规律也可能被打乱。比如,自由运行者某些日子在白天睡觉、夜晚清醒时,其心血管系统在该睡眠时段未得到应有的休息,而在另一些日子夜间熬夜又面临和普通人清晨类似的高交感应激,这种不可预测的循环可能增加心脏事件触发的机会。流行病学调查已将昼夜节律紊乱列为心血管疾病的风险因素之一 endocrinology.org 。总体而言,若长期每日本底节律漂移,心血管系统难以适应稳定的节奏,时间上的错配可能促使高血压、冠心病等问题提早出现。
内分泌免疫失调: 自由运行作息对其他生理系统也有潜在危害。首先,内分泌系统方面,除了上述胰岛素、瘦素等代谢激素,许多荷尔蒙都有昼夜波动(如皮质醇清晨高、夜晚低的规律)。睡眠和觉醒时间的移动会改变皮质醇释放的节奏,进而影响应激反应和免疫调节。慢性睡眠节律紊乱者可能出现皮质醇节律减弱或相位移位,造成免疫功能紊乱和炎症水平升高 pmc.ncbi.nlm.nih.gov 。一些研究表明,昼夜节律紊乱与促炎性细胞因子增加、免疫监视下降相关,从而可能提高某些疾病(如自身免疫疾病、感染)的风险 pmc.ncbi.nlm.nih.gov 。例如,倒班人员中一般感染和胃肠道紊乱的发生率较普通人高,被认为与免疫节律被扰乱有关。同理,每日作息飘移者的免疫细胞生理节奏(如淋巴细胞增殖活性、细胞因子分泌周期等)也可能无法同步正常昼夜周期,这可能导致免疫效率降低。免疫监视减弱还有一个长期隐患:** 肿瘤发生风险可能上升 pmc.ncbi.nlm.nih.gov 。世界卫生组织下属的国际癌症研究机构(IARC)已将“扰乱昼夜节律的轮班工作”列为可能的人类致癌因素。动物实验显示,持续的昼夜颠倒会促进肿瘤生长。自由运行的节律紊乱类似于持续的“内源性时差”,也可能伴随细胞周期和DNA修复节律的紊乱**,为癌变提供了可乘之机 pmc.ncbi.nlm.nih.gov 。当然,癌症风险的提升往往需要多年累积效应,对于一般的非24小时睡眠障碍患者,近期更突出的还是代谢和心血管方面的问题。但我们不应忽视其对整体健康的系统性影响。总之,从生理层面看,长期自由运行的作息会导致多系统失调:代谢紊乱、心血管风险增加、内分泌免疫节奏混乱等等。这些隐患往往隐匿积累,一旦显现可能就是慢性疾病。因此及早纠正作息,对维护生理健康至关重要。
睡眠剥夺与情绪调节障碍: 一个人若睡眠周期天天变化,他难以保证充足而高质量的睡眠。实际上,大多数自由运行节律患者在睡眠相位错位与社会要求不符时,会出现失眠和日间嗜睡交替的情况 sleepfoundation.org sleepfoundation.org 。当其睡眠时间移至白天但白天必须工作时,就会被迫缺眠;当睡眠时间碰巧轮转到夜晚,与正常作息对齐时,反而会睡得很好。这样断续的睡眠剥夺对情绪调节非常不利。研究表明,慢性睡眠不足会导致大脑情绪中心(如杏仁核)的反应过度,而前额皮质对情绪的调控能力下降,从而使人容易产生情绪波动和负面情感。自由运行节律患者常报告感觉自己情绪不稳、易怒焦虑。当睡眠相位和外界严重不同时(比如强迫自己白天上班,晚上又睡不着),他们的心情尤其低落,甚至会发展出抑郁症状 sleepfoundation.org 。一项对视力正常非24小时患者的研究中指出,这类患者在睡眠失调后,重度抑郁症的发生率显著增加(约34%的人发展出抑郁) pubmed.ncbi.nlm.nih.gov 。而且抑郁症状的严重程度和他们睡眠与日夜周期错乱的程度密切相关 sleepfoundation.org 。当经过一段时间轮转,睡眠恰好重新落在夜晚时,这些患者的抑郁情绪往往暂时缓解;而当睡眠相位再次游离正常时,抑郁加重 sleepfoundation.org 。这清楚地表明睡眠节律紊乱对情绪具有直接影响机制。同时,自由运行作息导致的社会功能受损(如无法按时上班、与他人作息不一致)也会诱发或加剧抑郁和焦虑。这种障碍给患者带来的心理压力是全方位的:白天的极度疲倦使其无法专注工作学习,产生自责和无力感;作息混乱使其很难参加社交活动,造成孤独和低落;长期的生理紊乱使其对未来健康焦虑不安。可以说,慢性昼夜节律紊乱对心理状态的负面影响深远且复杂,既直接通过大脑睡眠/觉醒中枢影响情绪,也通过社会生活质量间接影响心理。
认知功能与工作记忆受损: 正常的认知功能也受到规律睡眠的支撑。大脑的许多认知过程(注意力、记忆、执行功能等)具有昼夜节律调制,通常在清晨逐渐提高白天保持良好,在深夜显著下降。自由运行作息者由于睡眠和清醒时间在不断变化,大脑经常在非最佳时段被迫运转。举例来说,如果某天睡眠移到了白天,那么夜晚清醒时其大脑其实处于生物学夜晚,许多认知能力会比生物学白天降低。这导致这些患者常常感到认知迟钝、反应变慢。研究已经证实,昼夜节律紊乱会损害认知性能:一项关于轮班工人的研究发现,节律紊乱与工作记忆和处理速度的显著下降有关 pmc.ncbi.nlm.nih.gov 。参与该研究的受试者在节律打乱的条件下完成认知测验时,反应时间变慢、注意力难以集中 pmc.ncbi.nlm.nih.gov 。类似地,大规模人群数据显示,相对于节律正常者,生物节律紊乱的人群在反应时测试中成绩较差 pubmed.ncbi.nlm.nih.gov 。对自由运行的患者,我们预期会出现注意力不集中、短时记忆力下降、执行功能变差等问题。这些认知障碍很大程度上源于睡眠不足和错乱。例如,持续的困倦会影响专注和学习,新近发生的事情难以记忆巩固;昼夜节律的不一致也干扰海马体的记忆巩固过程(因为记忆巩固通常在夜间睡眠特定阶段发生,而他们的睡眠阶段次序异常)。另外,缺乏晨间清醒时段的规律锻炼,可能导致大脑可塑性降低。在工作或学习环境中,这会表现为生产力下降、错误率上升,严重时可能危及安全。尤其值得警惕的是,如果自由运行患者开车或操作机械,反应迟缓和注意涣散会带来事故风险,可类比为酒醉驾驶或极度疲劳驾驶。这对患者自身和公众都是潜在威胁。因此,从公共健康和个人发展角度看,纠正此类作息异常对于恢复认知功能和工作学习能力十分必要。
社交隔离与心理健康: 除情绪和认知外,自由运行作息对社交和心理福祉的影响也不容忽视。因为作息周期不断变化,这些人往往无法维持固定的社交日程。例如,他们某些日子白天在睡觉,无法上学或上班,也无法参与家庭活动;等过些日子睡眠转到夜间,白天清醒时,别人也许正忙于工作或补觉,错过了最佳交流时间。如此一来,患者和周围人的时间错位导致社交联系极不稳定。他们可能错过朋友聚会,长期缺勤于社交活动,从而产生强烈的孤独感和被疏远感 pmc.ncbi.nlm.nih.gov 。社会支持的缺乏又会恶化心理状态,形成恶性循环。许多患者描述自己感觉被正常社会“排除”在外,白天别人活动时自己无精打采,夜晚清醒时却找不到人可交流。这种状态下,自我评价容易降低,觉得“自己不正常”“无法融入社会”,可能诱发社交焦虑和自卑倾向。如果患者是学生或职场人士,频繁迟到、缺勤和精力不济会影响学业和职业表现,进一步打击自信心并引起经济、学业压力。这些负面影响累积,严重时可能导致患者陷入心理崩溃的边缘。有报告表明,自由运行睡眠障碍严重影响生活质量,以致一些患者被迫放弃工作,甚至需要申报残疾福利 sleepfoundation.org 。社交功能受损不仅是健康问题,也是社会问题。因此,应高度重视这类睡眠障碍对患者社会心理层面的冲击。
总的来说,长期每日推迟入睡的自由运行作息模式对身心健康都有显著隐患。生理上,它扰乱代谢与心血管平衡,增加慢性疾病风险;心理上,它导致情绪不稳和认知功能下降,损害社交和生活质量。这些影响很多是在无形中逐渐发展,初期可能仅表现为疲倦和轻度情绪低落,但随着时间推移可能演变为严肃的健康问题。因此,及时干预和矫正这种异常的睡眠节律,对于预防相关健康损害、恢复正常生活状态至关重要。下一节将着重讨论目前已有的干预方法和策略。
针对自由运行的睡眠–觉醒节律失调,目前尚无“一剂而愈”的简单疗法,但多种干预手段可以帮助患者逐步将生物钟重新锚定于24小时,并改善睡眠质量和日间功能。干预需要从行为、环境和药物等多个方面入手,通常是综合运用,以取得最佳效果 pmc.ncbi.nlm.nih.gov 。以下我们分类介绍几种主要的策略:
坚持规律作息: 最基础也最重要的措施是建立并坚持一个固定的作息时间表,包括固定的起床和就寝时间。对于自由运行倾向的人,尤为强调锚定起床时刻 my.clevelandclinic.org my.clevelandclinic.org 。因为与尝试提早入睡相比,每天在同一时间起床(无论昨晚何时入睡)更能逐步拉回生物钟。当每天清晨按计划起床并接触光照(下节详述),即使最初睡眠不足,到了新的一天夜晚身体会更易困倦入睡,如此日复一日,可慢慢逼近24小时节律。为配合这一过程,需要严格遵守周末和工作日一致的起床/就寝时间,避免周末“报复性赖床”破坏调整进程 my.clevelandclinic.org my.clevelandclinic.org 。患者可在睡眠日志中记录自己的实际睡眠和醒来时间,持续监督自己的进展。在行为上克服困难的关键在于循序渐进和自我监督:可以从当前习惯时间开始,每日将起床闹钟提前10-15分钟,逐步调整,避免一下子改动太大导致完全失眠 my.clevelandclinic.org 。这个过程需要数周甚至数月持续的努力,一旦有所松懈可能前功尽弃。因此,培养良好的睡眠卫生习惯和纪律非常重要,例如:晚上睡前一小时停止使用电子设备(屏幕蓝光会延迟褪黑素释放) my.clevelandclinic.org ;睡前放松身心,如洗温水澡、冥想等 my.clevelandclinic.org ;保持卧室黑暗安静,远离干扰 my.clevelandclinic.org ;下午及晚间避免摄入咖啡因和兴奋性活动 my.clevelandclinic.org ;白天尽量保持适度运动,以增进夜晚睡意。这些良好习惯的养成能帮助稳定睡眠驱动力,减少不必要的相位延后因素。在调整过程中,患者也需注意避免补觉和打盹。如果白天因为前夜少睡而困倦,应尽量用温和的运动、明亮光线提神,而不是睡长觉,否则会削弱晚上睡意。行为调整的核心理念就是给身体创造稳定的节律线索并重复强化,逐步引导内在生物钟与24小时重合。虽然这一过程对意志力是挑战,但临床经验表明,坚持规律作息数周后,大多数患者会感到睡眠变得可预测,白天精神也有所改善,从而增强信心继续下去。
相位调整疗法(Chronotherapy): 对于已经深陷自由运行节律的人,直接让其提早睡觉往往不切实际,因为其生理节奏惯性很强。一个替代方法是利用其“延迟倾向”通过渐进调整来实现校正。这被称为睡眠相位疗法或阶段性推延疗法。原理是按照患者原本的倾向,每天进一步推迟就寝时间,直到睡眠相位循环一整圈重新回到理想时间。例如,目前患者在凌晨5点入睡,那么可以安排下一晚7点入睡,再下一晚9点入睡…以2小时为增量逐日推后,经过大约12天,睡眠时间将被推移到傍晚或晚上正常时段 my.clevelandclinic.org 。此时患者已经昼夜颠倒一周多,最后停在目标时间(例如23点上床、7点起床),从第二天开始严格遵守这个正常作息,不再顺延。这样的chronotherapy利用了患者“容易熬夜、难提前睡”的特性,通过顺时针方向调整时序绕地球一圈,使其生物钟重新回位。这种方法曾有不少个案报道成功纠正了顽固的睡眠相位延迟 pmc.ncbi.nlm.nih.gov 。但是chronotherapy也存在风险:患者需要一段时间不工作学习,全力配合调整,并确保在结束时强力锚定新作息。如果中途打断或结束后未坚持规律,就可能出现我们前述的情况——治疗不成反而进入自由运行 pmc.ncbi.nlm.nih.gov 。因此,chronotherapy应该在专业医生指导下进行,并辅以其他手段巩固(如光照、药物)。对于已经自由运行的患者,有时也采用逆方向调整——即逐日提前睡眠时间(Phase Advance法),但这往往更困难,因为人天生更容易推迟而不善提前。通常,仅当延后法不可行时才尝试逐日提前30分钟-1小时的方式慢慢挪动睡眠相位。这需要极强的自律和外界监督。综上,睡眠相位调整疗法提供了一种重设生物钟的可能路径,但要谨慎应用,密切监测效果,并结合其它疗法以防反复。
晨光曝露: 光疗法是矫正昼夜节律的最有效环境手段之一。正如前文所述,光线对内在时钟有相位调整作用。针对自由运行(倾向延迟)的患者,原则上需要在主观晨间提供强光刺激以促使生物钟相位前移,从而每天“拉回”一些时间 pmc.ncbi.nlm.nih.gov 。具体做法通常是在患者希望的正常起床时间附近,给予高强度的明亮光照。这可以通过专用的光照治疗灯箱实现:患者早晨起床后坐在灯箱前30-60分钟,接受全光谱高亮度(通常至少2,500~10,000勒克斯)的光照 pmc.ncbi.nlm.nih.gov 。这样做的效果相当于将患者的生物钟每天固定地往前推,使之逐步同步到白天。临床研究表明,每天清晨坚持光照疗法能够显著帮助延迟性睡眠相位患者提前入睡醒来 pmc.ncbi.nlm.nih.gov 。对于自由运行节律患者,也有病例报告显示,每日晨间光照可以成功地让他们重新锚定24小时周期 pmc.ncbi.nlm.nih.gov 。值得注意的是,光疗法的计量和时间安排很重要:最佳时机是在患者自然醒来时间或略之前开始照光 pmc.ncbi.nlm.nih.gov 。比如,目标是早上7点起床,那么可以6:30开始打开灯箱。这要求患者即使困倦也要起身受光,不可贪睡。对于夜晚仍清醒的患者,可以先逐步调整至接近目标起床时,再开始规律晨光。除了灯箱,人们也可利用自然阳光——每天早起后出门晒半小时太阳有类似效果 my.clevelandclinic.org 。关键是光线强度和光谱(户外日光在晴天可达数万勒克斯,且含蓝光丰富,对抑制褪黑素最有效)。同时,还应避免夜晚不必要的光照:患者在晚间尤其临睡前两小时应减少亮光环境,尽量不使用电子屏幕,或使用滤蓝光眼镜/软件,将环境灯光调暗偏红。这种“避光”配合晨光,可以增大昼夜反差,从而强化节律信号 pmc.ncbi.nlm.nih.gov 。在一些病例中,甚至让患者**固定在黑暗中休息的时段(Dark Therapy)**来配合光疗,以明确区隔生理上的夜晚。
光疗法的挑战: 虽然原理清晰,但光照疗法的实际执行有一定挑战。很多自由运行患者由于长期晚睡,清晨强制起床照光初期会非常痛苦,可能坚持不下去。另外,光疗效应需要累积数日甚至数周才能完全体现,在此期间患者主观可能仍感觉困倦或睡眠不足,从而依从性下降 pmc.ncbi.nlm.nih.gov 。据报道,不少患者因为头几天效果不显著或感觉更疲惫而中断光疗,失去了后续可能的改善 pmc.ncbi.nlm.nih.gov 。因此,医护人员应在治疗开始前告知患者预期,并尽量提供支持(如联合咖啡因使用帮助晨间清醒,但需避免下午后摄入)。另一个问题是,一旦节律调整成功,光疗需要长期维持。很多病例显示,一旦停止每日规律光照,患者可能在数天内又开始延后睡眠 pmc.ncbi.nlm.nih.gov 。所以光疗本质上像戴眼镜矫正视力,需要持续,不是一劳永逸的。这方面,全盲患者的经验可以借鉴:他们需要天天在固定时间接受光替代信号(通常是服用褪黑素等方法)才能保持周期,否则极易迅速游离。这提醒我们,对于视力正常的非24小时患者,即便纠正后,仍应坚持早起晒太阳等习惯,以防重蹈覆辙。综上,光照疗法是纠正睡眠节律紊乱的强有力工具,清晨日光可被视为最廉价有效的药物。但成功的前提是患者强大的意志力与坚持。如能克服初期困难,光疗所带来的昼夜同步不仅改善睡眠,还能让患者白天精神提升、情绪好转,形成良性循环。
褪黑素补充: 药物方面,使用最广泛且针对根源的选择是外源性褪黑素。正如前述,褪黑素在体内是夜晚的“黑暗信号”,服用外源褪黑素可以起到调节生物钟和催眠的双重作用 pmc.ncbi.nlm.nih.gov 。对于睡眠相位延迟或自由运行的患者,正确时机服用小剂量褪黑素有助于提前内相位(chronobiotic作用),并可在服药当晚增加睡意缩短入睡时间 pmc.ncbi.nlm.nih.gov 。通常的指导是,在希望的入睡时刻前3-5小时左右服用低剂量(0.5mg~5mg)的褪黑素 my.clevelandclinic.org my.clevelandclinic.org 。比如目标23点就寝,可以傍晚18-20点服药。这相当于把体内的“黑夜”信号提前亮起,欺骗生物钟让其认为夜晚来临,从而推动节律前移。有研究显示,对于延迟性睡眠相位综合征患者,傍晚时段规律服用低剂量褪黑素能显著提前褪黑素内源分泌和睡眠时间 pmc.ncbi.nlm.nih.gov 。对于自由运行类型,有报告指出褪黑素可用于锚定24小时周期,包括在视力正常的自由运行患者中成功实现重新同步 pmc.ncbi.nlm.nih.gov 。在全盲患者中,褪黑素疗法效果尤其显著:每日同一时间服用适量褪黑素,许多盲人患者的睡眠–觉醒周期得以及时校正,重建了稳定的24小时节律 pmc.ncbi.nlm.nih.gov 。正因为此,美国已批准一种褪黑素受体激动剂塔西美琦(Tasimelteon)专门用于治疗盲人的非24小时睡眠–觉醒障碍 pmc.ncbi.nlm.nih.gov 。临床试验表明,每晚服用塔西美琦(20mg)可以使大约20%-40%的盲人患者从自由运行状态转为24小时规律(即“entrainment”),而停药后往往又失去同步 pubmed.ncbi.nlm.nih.gov pubmed.ncbi.nlm.nih.gov 。这提示我们,褪黑素及其类似物对于节律紊乱有实质疗效,但需要持续使用才能维持效果 pubmed.ncbi.nlm.nih.gov 。对于视力正常的患者,褪黑素同样可以使用,只是目前官方仅批准用于盲人非24,因为视力正常者数据较少。然而专家共识认为,对于顽固的自由运行节律者,尝试褪黑素(或受体激动剂)是合理的干预之一 pmc.ncbi.nlm.nih.gov 。重要的是,服药时间必须正确:若在错误时间服用,褪黑素可能适得其反地延后相位或无效 pmc.ncbi.nlm.nih.gov 。例如在生物学凌晨或早上服用褪黑素,可能延缓觉醒、推迟节律。因此医生应根据患者当前节律测定(如通过唾液褪黑素DLMO测量)来安排服药时段,以达到理想相位移动方向。
助眠药物和兴奋剂: 除了褪黑素这类“纠正生物钟”的药物,有时还需要借助其他药物来改善症状和过渡期的功能。 pmc.ncbi.nlm.nih.gov 一些传统助眠药(如短效安眠药物佐匹克隆、地美西泮等)可在患者必须提前就寝但难以入睡时临时使用,帮助入睡。这对于那些正尝试调整相位的患者(例如Chronotherapy结束后停在目标时间的第一天)可能有帮助,用药几晚使其顺利过渡。但安眠药仅治标不治本,长期并不能改变生物钟,而且有成瘾和耐受风险,需谨慎使用。同样地,早晨起床困难、白天嗜睡严重的患者,医生有时会开一些日间促醒药(如莫达非尼Modafinil、哌甲酯等兴奋剂)在白天服用,以提高清醒度 pmc.ncbi.nlm.nih.gov 。这可以帮助患者履行日间职责,避免因过度困倦而白天补眠,从侧面配合了节律调整。值得注意的是,兴奋剂应严格在早晨/白天使用,下午以后禁用,否则会干扰夜间入睡。还有一种特殊情况下的药物干预是针对抑郁等共病:如果患者因为节律紊乱出现了中度以上抑郁症状,适当使用抗抑郁药也有帮助。这些药物(如SSRIs选择性5-HT再摄取抑制剂)除了改善情绪,本身也可能略微影响昼夜节律基因表达,对节律有些许调节作用。不过主要仍是为了提高患者的心理状态,从而增强其执行行为疗法的意愿和能力。需要强调的是,所有药物手段都应辅以前述的行为和环境干预,单靠药物往往无法根治此类问题。例如仅服安眠药而不调整作息,停药后问题依旧;仅服褪黑素而白天依然躲避阳光,效果也有限。理想的方案是综合治疗:傍晚准时服褪黑素,晚上减少蓝光,定点上床;清晨闹钟响起后,必要时小剂量兴奋剂助醒并配合强光照射,然后保持规律的日间活动。如此全方位协同,才能逐步稳固生物钟的转变。
新型药物与研究: 值得一提的是,随着对昼夜节律机理的深入了解,新型药物正在研发中。例如,**拉梅尔通(Ramelteon)**是一种褪黑素受体激动剂,已用于治疗失眠,它理论上也可用于节律紊乱的矫正且无成瘾性。有研究在少量DSPS患者中试用拉梅尔通,显示一定效果,但样本有限。维甲型受体激动剂(如阿戈美拉汀Agomelatine)同时作用于褪黑素和5-HT受体,被用作抗抑郁药,可能在改善情绪的同时调整节律,对兼有抑郁的患者有潜在益处。此外,针对核心时钟基因通路的分子药物也在动物模型中探索,例如调节PER蛋白降解的CK1δ抑制剂等,未来有望成为节律紊乱的新疗法。但目前这些仍在研究阶段,离临床应用尚有距离。当下能够使用且有实证支持的仍是褪黑素及其类似物。在现实中,一些患者也会尝试营养补充剂如维生素B12等——早年日本学者曾报告大剂量B12或可促进昼夜节律同步,但后续证据不充分,如今已不作为常规推荐。总的来说,药物干预在非24小时睡眠障碍的治疗中扮演辅助而非单一的角色,需要个体化调整剂量和时间,并监测效果和副作用。
心理支持与治疗: 鉴于此类睡眠紊乱往往伴随心理问题,心理疏导和治疗同样重要。睡眠医生常会建议患者接受认知行为治疗(CBT)的某些模块,特别是针对失眠的CBT-I技术,以纠正不良睡眠认知和行为。例如,帮助患者去除对睡不着的焦虑,建立信心,学习放松技巧,这些都有利于配合生物钟调整。对于因作息紊乱导致抑郁的患者,支持性心理治疗可以减轻其孤立感,鼓励其积极遵守治疗计划。此外,“社会节律疗法”是心理学领域针对双相情感障碍等设计的一种疗法,强调维持日常生活规律(进餐、活动、睡觉的固定时间)以稳定情绪节律。这个理念也适用于本病,患者可在治疗师指导下努力恢复社交和日常活动的规律性,将其视为与生物钟重建同等重要的任务。家人和朋友的理解支持也非常关键。家属应了解这是一个生理紊乱,不仅仅是懒散,给予患者鼓励和协助,例如早晨叫醒并陪伴晒太阳,夜晚创造安静环境等。有条件的话,参加睡眠障碍互助小组也能让患者获得经验分享和情感支持,提升依从性。
健康生活方式与锻炼: 任何改善健康的措施都有助于增强机体对抗节律紊乱的能力。例如,坚持规律锻炼(最好在白天进行)不仅改善睡眠质量,还能强化昼夜节律信号。白天运动会升高体温、释放兴奋递质,使身体更明确地区分“昼”和“夜”。傍晚适度运动也可帮助消耗精力,为夜间更好入睡做准备。饮食上,均衡营养和定时用餐可以同步外周生物钟(如肝脏、胰腺的节律),减轻节律紊乱带来的代谢负担 pmc.ncbi.nlm.nih.gov 。有些研究建议,早餐应在固定时间进食,不要因为起床晚就跳过,这样可以给身体一个稳定的开始信号。同理,避免深夜进食,以免干扰夜间代谢休息模式。避免酒精和尼古丁也很重要。虽然一些人用酒精助眠,但酒精会扰乱睡眠结构且影响褪黑素分泌,使问题恶化;尼古丁则是兴奋剂,尤其夜间吸烟可让入睡更难且扰乱节律。总的来说,良好的生活习惯是基础,它们本身虽不能治愈自由运行节律,但为其它干预创造了良好条件,相当于“治土”以利于“治时”。有了健康的身体和积极的心理状态,生物钟调节才能事半功倍。
专业医疗介入: 面对顽固病例,睡眠医学专科的介入是必要的。医生可以通过多种客观手段评估患者节律,如多日的腕动计监测和睡眠日志纪录,以确诊非24小时模式并量化其周期长度。必要时检查褪黑素节律(如测量傍晚唾液褪黑素DLMO)来指导治疗时序 pmc.ncbi.nlm.nih.gov 。在排除其它睡眠障碍(如睡眠呼吸暂停等)的前提下,医生会制定个体化的综合干预方案,包括前述行为、光照、药物的组合。同时需要定期随访,根据进展调整策略。对于由于其它疾病引起的节律紊乱(如抑郁症、阿尔茨海默症等),还需要同时治疗原发病。另外,如果患者的自由运行节律已造成严重生活功能障碍,在矫正过程中可考虑阶段性地调整工作/学习安排,例如申请弹性工作制、远程办公或休学休假,待节律改善后再恢复正常。这比硬撑着上班上课却疗效甚微要更有利长远。现实中,有些患者可能无法完全纠正节律(尤其极端顽固的情况),那么医生会帮助他们学习代偿策略:如在节律错位时如何保证安全、如何利用短暂小睡和咖啡因提神渡过关键时段,以及心理上如何应对焦虑。在罕见情况下,如果治疗无效且患者痛苦难当,倒也存在顺其自然的生活方式选择——比如按照自己的25小时周期生活,职业上选择不需要固定时间的工作或夜班工作,以减少与社会节律冲突。但这毕竟并非理想方案,因为对身体仍有潜在危害。因此医学界仍致力于寻找更有效的治疗方法,包括对视力正常非24小时患者开展临床试验等 pmc.ncbi.nlm.nih.gov 。未来,随着对时钟基因和光生物学理解加深,或许会出现新的突破疗法。
每日推迟入睡时间约1小时的长期作息现象,本质上反映了人体生物钟未能与24小时地球周期同步,是“非24小时睡眠–觉醒节律失调(自由运行节律)”的一种具体表现。通过本文的分析,我们厘清了这一现象与普通睡眠相位延迟的区别,并探讨了其生理和心理机制:内因上,固有生物节律周期偏长、褪黑素分泌节奏延后以及光照线索缺乏共同促成了节律的逐日漂移;外因上,不良的作息习惯和心理因素(如夜晚偏好、社交隔离等)进一步将个体推向自由运行状态。长期维持这种紊乱的作息对健康的威胁是多方面的——在生理上可导致代谢失调、心血管风险上升、内分泌免疫紊乱等隐患,在心理上则会引发情绪障碍、认知功能下降和社会功能受损,极大降低生活质量。这些发现强调了将自由运行的睡眠节律重新调整回正常周期的重要性。幸运的是,现代睡眠医学提供了多种干预工具:通过严格的行为调整(规律作息和睡眠卫生)、利用光照疗法强化昼夜信号、辅以褪黑素等药物微调生物钟,以及心理支持和生活方式改善,我们有机会帮助患者逐步找回与地球日夜同步的生活。虽然这一过程往往需要相当的毅力和时间,但其回报是巨大的——重获稳定的睡眠、清爽的白天以及身心的健康。展望未来,随着对昼夜节律研究的深入,治疗自由运行节律障碍的手段将更加精确和有效。例如,更强效而安全的褪黑素类似物、新的时钟基因调节药物、个性化光照设备等,都可能提高治疗成功率。在此之前,教育公众和临床医务人员认识这种少见但影响深远的睡眠障碍,及时诊断和干预,是当务之急。总之,自由运行的睡眠节律并非无法逆转的命运,通过科学的认知和综合干预,完全有可能将“迷失”的生物钟重新导航回正轨,为患者带来白天的清醒和夜晚的安睡,这是值得我们共同努力的方向。
参考文献:
Kim MJ, Lee JH. Circadian Rhythm Sleep Disorders. J Clin Outcomes Manag. 2013 Nov 01;20(11):513-528【131101 ☺ Kim】. (综述了各类昼夜节律睡眠障碍,包括自由运行型的定义、特征及治疗方法)
Patke A et al. Mutation of the Human Circadian Clock Gene CRY1 in Familial Delayed Sleep Phase Disorder. Cell. 2017 Apr 06;169(2):203–215【170406 ☺ Patke】. (揭示CRY1基因变异可延长人体固有昼夜周期至约24.5小时,导致睡眠相位延迟)
Doghramji K. Melatonin and Its Receptors: A New Class of Sleep-Promoting Agents. J Clin Sleep Med. 2007 Aug 15;3(5 Suppl):S17–S23【070815 ☺ Doghramji】. (介绍褪黑素的生理作用以及在睡眠节律调节中的角色)
Khullar A. The Role of Melatonin in the Circadian Rhythm Sleep-Wake Cycle. Psychiatric Times. 2012 Jul 09;29(7)【120709 ☺ Khullar】. (论述褪黑素分泌节律及其与睡眠倾向的关系)
Garbazza C, Benedetti F. Non-24-Hour Sleep-Wake Disorder in Sighted Patients: Dealing With an Orphan Disease. J Clin Sleep Med. 2018;14(7):1081-1082【180614 ☺ Garbazza】. (讨论视力正常人群中非24小时睡眠觉醒障碍的临床挑战,强调其罕见性和严重后果)
Woller A et al. Circadian Misalignment and Metabolic Disorders: A Story of Twisted Clocks. Biology (Basel). 2021 Mar 10;10(3):207【210310 ☺ Woller】. (综述昼夜节律紊乱对代谢健康的影响,指出节律失调可诱发肥胖、糖尿病等)
Ahmad M et al. The Effects of Circadian Rhythm Disruption on Mental Health and Physiological Responses among Shift Workers and General Population. Int J Environ Res Public Health. 2020 Sep 30;17(19):7156【200930 ☺ Ahmad】. (研究昼夜节律紊乱对情绪和认知的影响,发现其显著损害情绪稳定和认知性能)
Lyall LM et al. Association of Disrupted Circadian Rhythmicity with Mood Disorders, Subjective Wellbeing, and Cognitive Function. Lancet Psychiatry. 2018 Jun;5(6):507-514【180515 ☺ Lyall】. (基于UK Biobank的大样本研究,证明客观节律紊乱与抑郁、双相等情绪障碍及认知功能下降相关)
Hayakawa T et al. Clinical Analyses of Sighted Patients with Non-24-hour Sleep-Wake Syndrome: A Study of 57 Cases. Sleep. 2005 Aug 01;28(8):945-952【050801 ☺ Hayakawa】. (对57例视力正常非24小时睡眠觉醒综合征患者的临床特征分析,报告平均周期约24.9小时,青春期起病常见,抑郁共病高发)
Hunter L. Out of time: circadian misalignment and metabolic health. The Endocrinologist. 2019 Winter;(134):14-16【191201 ☺ Hunter】. (概述昼夜节律与心代谢健康的关系,指出节律错乱可导致胰岛素抵抗、高血压等)
Fry A. Non-24 Hour Sleep-Wake Disorder: Symptoms & Diagnosis. Sleep Foundation (2021)【210201 ☺ Fry】. (患者教育资料,描述非24小时睡眠觉醒障碍的症状、诊断和风险因素,并提供案例图示)